
甲烷不充分燃烧
2CH4+3O2=2CO+4H2O
如果这个时候继续充入O2,
2CO + O2=2CO2
氢氧化钠不足时
Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4
这时候继续滴入氢氧化钠,生成的Al(OH)3会继续反应,生成偏铝酸钠。
Al(OH)3+NaOH=NaAlO2+2H2O
对于某些反应物的不足或过量此类问题,这期我们将解决几个精彩的问题
1、函数y=1/x (x>0)在x>0上是减函数,且y>0恒成立。 若有实数a、b,a>0,b>0。
当a>b时,0<1/a<1/b;当a≥b时,0<1/a≤1/b;
当a<b时,1/a>1/b>0;当a≤b时,1/a≥1/b>0。
2.若有反应式A+B+…→C+D+…其中n(A)>0且n(B)>0。
【那么n(A)/n(B)>0且n(B)/n(A)>0】。
若A的物质的量越多或B物质的量越少,那么n(A)/n(B)越大,n(B)/n(A)越小;
若A的物质的量越少或B物质的量越多,那么n(A)/n(B)越小,n(B)/n(A)越大。
3.若有等式或方程式a+b+c+…=d+e+…。移项后新等式成立,比如a+b+…=d+e-c+…。
把方程两边都加上(或减去)同一个数或同一个整式,就相当于把方程中的某些项改变符号后,从方程的一边移到另一边,这样的变形叫做移项。
本篇文章化学式上下标无法体现,敬请谅解。
2CH4+3O2=2CO+4H2O 【1】
继续充入氧气,2CO + O2=2CO2
假设在生成的2个(或2mol)CO中,有x个(或xmol)CO再次反应生成CO2,容易知道0≤x≤2。
xCO + x/2 O2=x CO2 【2】
反应物多了x/2个O2,生成物多了x个 CO2,x个CO反应后剩下(2-x)CO,那么反应式就是
2CH4+3O2+ x/2 O2=(2-x)CO+x CO2+4H2O
化简得
2CH4+(3+ x/2) O2=(2-x)CO+x CO2+4H2O【3】
由于0≤x≤2则3≤(3+ x/2)≤4。
令氧气物质的量/甲烷物质的量=n(O2)/n(CH4)=k>0,则n(CH4)/n(O2)=1/k>0。
K=(3+ x/2)/2,则3/2≤k≤2,1/2≤1/k≤2/3。
当x=0时k=3/2,对应反应式2CH4+3O2=2CO+4H2O【4】代表氧气不足,完全参加反应生成CO,没有CO再次反应生成CO2。显然,1/k继续增大(即k继续减小)反应式仍然是【4】。
即k≤3/2或1/k≥2/3时代表氧气不足,甲烷过量的反应式,此时定量计算采用氧气的量计算,因为氧气完全反应而甲烷完全反应或甚至有剩余。
当x=2时k=2,对应反应式2CH4+4O2=2 CO2+4H2O即CH4+2O2= CO2+2H2O【5】代表氧气充足,所有甲烷参加反应,生成的CO全部生成CO2,已不存在CO。
显然,k继续增大(即1/k继续减小)反应式仍然是【5】。即k≥2或1/k≤1/2时代表氧气充足,甲烷不足的反应式。此时定量计算采用甲烷的量计算,因为甲烷完全反应,而氧气完全反应或甚至有剩余。
当然【3】包含【3】【4】【5】三种情况,【4】【5】是【3】的特例(x=0或x=2的特例)。
当3/2<k<2即1/2<1/k<2/3时代表甲烷和氧气均完全反应无剩余,反应式是【3】。
由以上知,能写出0≤x≤2:
2CH4+(3+ x/2) O2=(2-x)CO+x CO2+4H2O【3】是分析、解决问题的核心。平而通过不足量反应【1】和中间反应【2】可以拼凑出最终等效反应【3】。
可根据实际需要,对化学方程式的系数进行调整,比如化简成
0≤x≤2:
CH4+(3/2+ x/4) O2=(1-x/2)CO+x/2 CO2+2H2O【6】
若令y=3/2+ x/4,则3/2≤y≤2。
CH4+y O2=(4-2y)CO+(2y-3) CO2+2H2O【7】
其中2≤4-2y≤5/2,0≤2y-3≤1。
三、硫酸铝与不足量氢氧化钠发生反应
氢氧化钠不足时
Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4 【1】
继续滴入氢氧化钠
Al(OH)3+NaOH=NaAlO2+2H2O 【2】
则X Al(OH)3+x NaOH=x NaAlO2+2x H2O
代入反应式左右
Al2(SO4)3+6NaOH+x NaOH=(2-x)Al(OH)3↓+3Na2SO4+x NaAlO2+2x H2O
化简后
0≤x≤2:
Al2(SO4)3+(6+x)NaOH=(2-x)Al(OH)3↓+3Na2SO4+x NaAlO2+2x H2O【3】
因为0≤x≤2,所以6≤(6+x)/1≤8。
令n(NaOH)/n(Al2(SO4)3)=k>0,则n(Al2(SO4)3)/n(NaOH)=1/k>0。
6≤k≤8即1/8≤1/k≤1/6时使用【3】分析。
当NaOH不足(Al2(SO4)3过量)时,k≤6,即1/k≥1/6,使用【1】分析。
当NaOH充足(Al2(SO4)3不足)时,表示k≥8,即1/k≤1/8,使用【2】分析。
在此类问题中一律使用不足量的反应物的量进行定量计算。
王再来试试使用离子方程式分析:
Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4
Al(OH)3+NaOH=NaAlO2+2H2O
写成离子方程式
Al3++3OH- =Al(OH)3↓ 【1】
Al(OH)3+OH-=AlO2-+2H2O
x Al(OH)3+ xOH-= xAlO2-+2x H2O 0≤x≤1【3】
【1】+【3】即反应物相加,生成物相加。
Al3++3OH-+ xAl(OH)3+xOH- =
Al(OH)3↓+xAlO2-+2x H2O
反应物和生成物均有Al(OH)3,所以必须将它移至生成物。移动过程遵循数学等式中的移项法则。
把+ xAl(OH)3移至右边变成- xAl(OH)3
Al3++3OH-+ xOH-=Al(OH)3↓-xAl(OH)3↓+xAlO2-+2x H2O
再化简
Al3++(3+ x)OH-=(1-x)Al(OH)3↓+xAlO2-+2x H2O
其中0≤x≤1,3≤(3+ x)/1≤4。
令n(OH-)/n(Al3+)=k>0,则n(Al3+)/n(OH-)=1/k>0。则3≤k≤4,1/4≤1/k≤1/3
即k≤3或1/k≥1/3表示OH-不足(Al3+充足)。
k≥4或1/k≤1/4表示OH-充足(Al3+不足)。
 退休人员请注意!2024年1月起,养老金资格怎么认证,按这3种办法来一旦错过将暂停发放!退休人员请注意!2024年1月起,养老金资格怎么认证,按这3种办法来一旦错过将暂停发放!
退休人员请注意!2024年1月起,养老金资格怎么认证,按这3种办法来一旦错过将暂停发放!退休人员请注意!2024年1月起,养老金资格怎么认证,按这3种办法来一旦错过将暂停发放!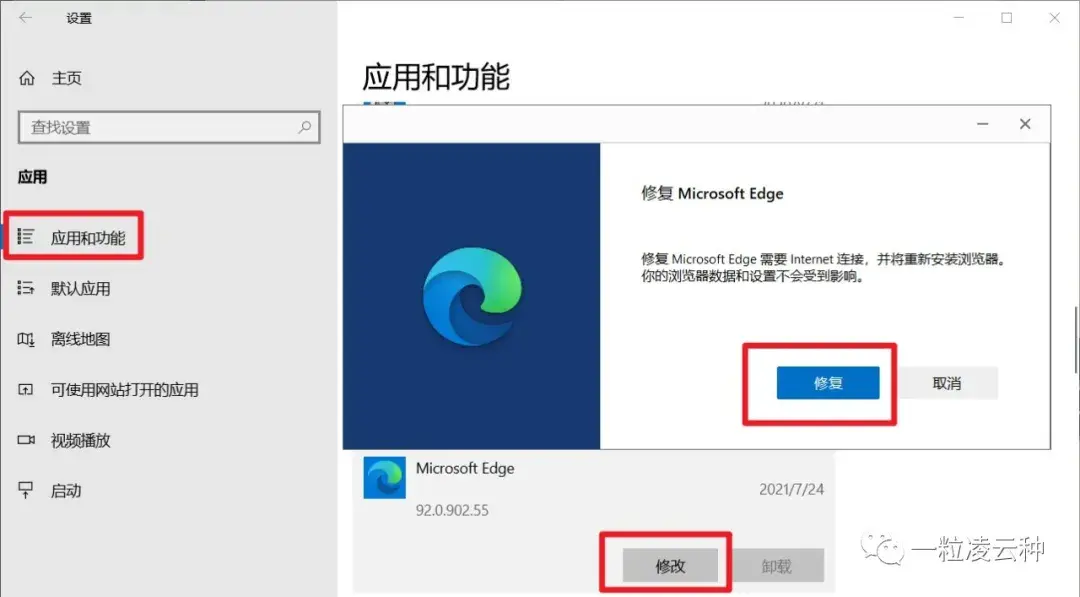 修改主页的方法( 修改被篡改的浏览器主页)修改主页的方法( 修改被篡改的浏览器主页)
修改主页的方法( 修改被篡改的浏览器主页)修改主页的方法( 修改被篡改的浏览器主页) 朋友的定义是什么(何谓“朋友”?)朋友的定义是什么(何谓“朋友”?)
朋友的定义是什么(何谓“朋友”?)朋友的定义是什么(何谓“朋友”?) 汽车清洗剂汽车专用(新手怎么选用汽车清洗剂?)汽车清洗剂汽车专用(新手怎么选用汽车清洗剂?)
汽车清洗剂汽车专用(新手怎么选用汽车清洗剂?)汽车清洗剂汽车专用(新手怎么选用汽车清洗剂?) 压声喊麦技巧和发声方法(喊麦怎么练声,需要掌握哪些技巧)压声喊麦技巧和发声方法(喊麦怎么练声,需要掌握哪些技巧)
压声喊麦技巧和发声方法(喊麦怎么练声,需要掌握哪些技巧)压声喊麦技巧和发声方法(喊麦怎么练声,需要掌握哪些技巧) 开卷是否有益是什么意思(开卷有益吗?)开卷是否有益是什么意思(开卷有益吗?)
开卷是否有益是什么意思(开卷有益吗?)开卷是否有益是什么意思(开卷有益吗?)